Често се говори
за две припокриващи се основни причини за инсулинова резистентност на клетъчно
ниво. Едната от тях е своеобразно мастно
отравяне/натрупване на мазнини (fat overload) в тъканите. Предполага се, че основната причина за това натрупване на мазнини са високи
нива на свободни мастни киселини. Обичайно е хората с
наднормено тегло да имат високи нива на свободни мастни киселини в кръвта, а
повечето с инсулинова резистентност също са с наднормено тегло.
Свободните мастни киселини представляват мазнини, които се отделят от мастната тъкан и са готови за използване. Те са мазнини, готови за изгаряне като източник на енергия. Високо ниво на свободни мастни киселини често се разглежда като признак, че мастната тъкан е инсулиноворезистентна, защото инсулинът възпрепятства отделянето на свободни мастни киселини и стимулира мастната тъкан към складиране. Мастната тъкан трябва да отдава мазнини, когато е налице недостиг на храна (между храненията), а да задържа мазнините, когато е налице достатъчно храна.
Ако мастната тъкан стане инсулиноворезистентна, тя не реагира правилно – да задържа мазнините, когато нивото на инсулина е високо. Вместо това тя отдава енергия, въпреки че в кръвта постъпва друга енергия от храната. Всъщност свободните мастни киселини трябва да се транспортират до тъканите и да се изгарят, но ако сме приели с храната прекалено много въглехидрати и не сме се движили достатъчно, тъканите на организма на първо място ще се стремят да изгарят въглехидрати. Затова мастните киселини биват транспортирани от мастната тъкан в други тъкани, където остатъчни продукти (церамиди и диацилглицероли) нарушават инсулиновата сигнализация в тези клетки.
Инсулиноворезистентните хора или онези с метаболитен синдром имат голямо складиране на мазнини в телесните тъкани, които всъщност не би трябвало да съдържат толкова много мазнини. Например могат да се наблюдават много вътремускулни мазнини – нещо, за което се предполага, че прави мускулите инсулиноворезистентни. Също така и панкреасът може по същия начин да се изпълни с мазнини и е възможно вследствие на това клетките да престанат да функционират или дори да загинат. Това е част от развитието на диабет втори тип.
Затлъстелият черен дроб (стеатоза), заболяване, което в миналото беше обичайно само сред алкохолиците, днес е напълно обичайна диагноза и се среща доста последователно в съчетание с инсулиновата резистентност. Това състояние днес се нарича NAFLD (Non-Alcoholic Fatty Liver Disease) (неалкохолна мастна чернодробна болест). При NAFLD черният дроб се изпълва с мазнини подобно на гъшия черен дроб (фоа гра). Птиците имат голяма способност да складират мазнини в черния дроб, защото мазнините се използват като източник на енергия за дълги полети. При хората мазнините трябва да се складират на първо място в мастната тъкан. Мазнините в черния дроб идват от три източника: от храната, от собственото производство на мазнини на черния дроб или от мастната тъкан. Изглежда, че основният проблем са мазнините, които се произвеждат в черния дроб, заедно с мазнините, които се отделят от мастната тъкан. Когато черният дроб произвежда мазнини (де ново липогенеза), той ги произвежда от въглехидрати. Мазнините от храната, които се усвояват и отвеждат до черния дроб, няма да представляват проблем, ако черният дроб в същото време не е принуден да преобразува въглехидрати в мазнини и не са му подадени много мазнини от мастната тъкан [1]. Излишъкът на въглехидрати и особено на фруктоза се трансформира в мазнини в черния дроб, преди да се изпрати в мастната тъкан за складиране. Предполага се, че фруктозата допринася особено силно за NAFLD. Мазнините от мастната тъкан също нямаше да бъдат проблем, ако само ги изгаряхме за енергия, например в мускулите. Но, както посочихме, ако в храната преобладават въглехидратите, те ще се изгарят с предимство пред мазнините. Донъли и колеги са установили, че 59% от мазнините в черния дроб произхождат от свободни мастни киселини, които идват на първо място от мастната тъкан, а около 26% идват от де ново липогенеза и 15% от храната [2].
NAFLD може след време да доведе до сериозно чернодробно заболяване, а това повишава риска за възникване на рак на черния дроб.
Свободните мастни киселини представляват мазнини, които се отделят от мастната тъкан и са готови за използване. Те са мазнини, готови за изгаряне като източник на енергия. Високо ниво на свободни мастни киселини често се разглежда като признак, че мастната тъкан е инсулиноворезистентна, защото инсулинът възпрепятства отделянето на свободни мастни киселини и стимулира мастната тъкан към складиране. Мастната тъкан трябва да отдава мазнини, когато е налице недостиг на храна (между храненията), а да задържа мазнините, когато е налице достатъчно храна.
Ако мастната тъкан стане инсулиноворезистентна, тя не реагира правилно – да задържа мазнините, когато нивото на инсулина е високо. Вместо това тя отдава енергия, въпреки че в кръвта постъпва друга енергия от храната. Всъщност свободните мастни киселини трябва да се транспортират до тъканите и да се изгарят, но ако сме приели с храната прекалено много въглехидрати и не сме се движили достатъчно, тъканите на организма на първо място ще се стремят да изгарят въглехидрати. Затова мастните киселини биват транспортирани от мастната тъкан в други тъкани, където остатъчни продукти (церамиди и диацилглицероли) нарушават инсулиновата сигнализация в тези клетки.
Инсулиноворезистентните хора или онези с метаболитен синдром имат голямо складиране на мазнини в телесните тъкани, които всъщност не би трябвало да съдържат толкова много мазнини. Например могат да се наблюдават много вътремускулни мазнини – нещо, за което се предполага, че прави мускулите инсулиноворезистентни. Също така и панкреасът може по същия начин да се изпълни с мазнини и е възможно вследствие на това клетките да престанат да функционират или дори да загинат. Това е част от развитието на диабет втори тип.
Затлъстелият черен дроб (стеатоза), заболяване, което в миналото беше обичайно само сред алкохолиците, днес е напълно обичайна диагноза и се среща доста последователно в съчетание с инсулиновата резистентност. Това състояние днес се нарича NAFLD (Non-Alcoholic Fatty Liver Disease) (неалкохолна мастна чернодробна болест). При NAFLD черният дроб се изпълва с мазнини подобно на гъшия черен дроб (фоа гра). Птиците имат голяма способност да складират мазнини в черния дроб, защото мазнините се използват като източник на енергия за дълги полети. При хората мазнините трябва да се складират на първо място в мастната тъкан. Мазнините в черния дроб идват от три източника: от храната, от собственото производство на мазнини на черния дроб или от мастната тъкан. Изглежда, че основният проблем са мазнините, които се произвеждат в черния дроб, заедно с мазнините, които се отделят от мастната тъкан. Когато черният дроб произвежда мазнини (де ново липогенеза), той ги произвежда от въглехидрати. Мазнините от храната, които се усвояват и отвеждат до черния дроб, няма да представляват проблем, ако черният дроб в същото време не е принуден да преобразува въглехидрати в мазнини и не са му подадени много мазнини от мастната тъкан [1]. Излишъкът на въглехидрати и особено на фруктоза се трансформира в мазнини в черния дроб, преди да се изпрати в мастната тъкан за складиране. Предполага се, че фруктозата допринася особено силно за NAFLD. Мазнините от мастната тъкан също нямаше да бъдат проблем, ако само ги изгаряхме за енергия, например в мускулите. Но, както посочихме, ако в храната преобладават въглехидратите, те ще се изгарят с предимство пред мазнините. Донъли и колеги са установили, че 59% от мазнините в черния дроб произхождат от свободни мастни киселини, които идват на първо място от мастната тъкан, а около 26% идват от де ново липогенеза и 15% от храната [2].
NAFLD може след време да доведе до сериозно чернодробно заболяване, а това повишава риска за възникване на рак на черния дроб.
Ако инсулиновата
резистентност започва с това, че мастната тъкан не реагира на инсулина, тогава
въпросът е какво е нарушило функционирането на мастната тъкан. Тук стигаме до
второто главно обяснение за инсулиновата резистентност: възпалителният процес. Повишеното
възпалително състояние е част от метаболитния синдром, а наднорменото тегло се
разглежда като хронично слабо възпаление. Това се наблюдава например във връзка
с патологичната картина, която се развива вследствие на метаболитния синдром,
като мускулни възпаления, инфекции, астма, алергии, ревматични страдания,
фибромиалгия, псориазис и подобни. Всички те са симптоми, които се подобряват
от същите интервенции, които водят до подобрение на метаболитния синдром.
Въпросът е защо има толкова силно възпаление. Според една теория, когато мастната тъкан се разраства бързо, защото складира много енергия, това стресира някои от клетките (ендоплазмен ретикулум). Това стресиране кара мастната тъкан да отделя възпалителни вещества (напр. c-Jun N-terminal kinase), което води до атакуване на мастната тъкан от бели кръвни телца (макрофаги) в отговор на стресовата реакция. Висок брой бели кръвни телца в мастната тъкан е обичайно явление при наднормено тегло. Антъни Феранте твърди, че 5% от мастната тъкан при хората с нормално тегло се състои от бели кръвни телца (макрофаги), а при хората с наднормено тегло числото е почти 50% [3]. Стресът върху ендоплазмения ретикулум се осъществява и в черния дроб, което може да попречи на черния дроб да отделя триглицериди в кръвта [4].
В съчетание с това нахлуване на бели кръвни телца в мастната тъкан, се наблюдава също така загиване на мастни клетки. Ако имате мастна тъкан, която лесно се разширява и образува нови мастни клетки, сте защитени от инсулинова резистентност. Много хора с наднормено тегло, включително сред силно затлъстелите, не стават инсулиноворезистентни и също така са създадени животински модели, които лесно наддават на тегло и не стават инсулиноворезистентни. Както посочих в предишната статия, само хора и животни с липодистрофии, които не могат да складират мазнини по нормалния механизъм, ще развият инсулинова резистентност. Това показва, че мастната тъкан може да стане дисфункционална, когато достигне индивидуална граница на разширяване – граница, която се влияе както от наследствени фактори, така и от околната среда.
Друг аспект при възпалителните процеси е, че висок прием на въглехидрати довежда до високи нива на реактивни оксигени (ROS). Ограничаването на консумацията на въглехидрати (или кетогенните диети) намаляват нивото им както при хората, така и при животните. Една от причините за високи нива на ROS са клетъчни увреждания вследствие на повишена кръвна захар. Високи нива на ROS могат да се получат и от висок натиск върху митохондриите да изгарят свободни мастни киселини.
Способността на митохондриите да изгарят мазнини заема централно място и при инсулиновата резистентност. Нивото на свободните мастни киселини се повишава, защото в кръвта се отделят повече, отколкото се изгарят. Ако повишим изгарянето на мазнини, подобряваме състоянието на заболяването, поради което лечението на метаболитния синдром чрез промяна в начина на живот е свързано с увеличаване изгарянето на мазнини.
Много специалисти по храненето смятат погрешно, че инсулиновата резистентност се причинява от висок прием на мазнини. Според тях приемът на мазнини е причината за затлъстяването, сърдечносъдовите заболявания и всички последващи заболявания. Една от причините да се обвиняват мазнините е, че в проучвания е наблюдавано, че висок прием на мазнини води до инсулинова резистентност. За съжаление тези проучвания често се тълкуват погрешно.
Пример за такова проучване имаме от 2001 г. [5]. Учените дали три различни хранителни режима на здрави мъже в различни моменти и измерили инсулиновата чувствителност след всеки режим. Енергийната стойност и съдържанието на белтъчини на трите режима били еднакви. Мазнините и въглехидратите били разпределени съответно по следните начини: 0% мазнини и 85% въглехидрати, 41% мазнини и 44% въглехидрати или 83% мазнини и 2% въглехидрати. Учените установили, че след висок прием на мазнини черният дроб реагирал по-слабо на инсулина, т.е. произвеждал по-малко въглехидрати, отколкото при другите хранителни режими. Действително е вярно, че един от проблемите при хората, които развиват висока кръвна захар, е, че черният дроб не намалява производството на кръвна захар, както би трябвало, когато бъде изложен на действието на инсулина. Но този проблем се среща при хора, консумиращи много въглехидрати и които в същото време имат висока захар в кръвта от храната.
Високото ниво на кръвната захар е опасно, но ниското ниво може да бъде далеч по-опасно, особено за мозъка. Затова е важно, когато не се консумират въглехидрати (2%), черният дроб да продължи да произвежда глюкоза, за да не спадне кръвната захар прекалено ниско. Именно това се случва, когато се консумират много мазнини. Но това е положителна и естествена адаптация. Ако се продължи с висок прием на мазнини, се получава ниска и естествена кръвна захар, като в същото време се намалява телесното тегло и мазнините в черния дроб, панкреаса и други органи се използват за енергия, което води до подобряване на инсулиновата чувствителност на тези органи.
Учените зад гореспоменатото изследване изглежда са били изненадани от значението на това откритие с оглед на диабета и са написали:
Въпросът е защо има толкова силно възпаление. Според една теория, когато мастната тъкан се разраства бързо, защото складира много енергия, това стресира някои от клетките (ендоплазмен ретикулум). Това стресиране кара мастната тъкан да отделя възпалителни вещества (напр. c-Jun N-terminal kinase), което води до атакуване на мастната тъкан от бели кръвни телца (макрофаги) в отговор на стресовата реакция. Висок брой бели кръвни телца в мастната тъкан е обичайно явление при наднормено тегло. Антъни Феранте твърди, че 5% от мастната тъкан при хората с нормално тегло се състои от бели кръвни телца (макрофаги), а при хората с наднормено тегло числото е почти 50% [3]. Стресът върху ендоплазмения ретикулум се осъществява и в черния дроб, което може да попречи на черния дроб да отделя триглицериди в кръвта [4].
В съчетание с това нахлуване на бели кръвни телца в мастната тъкан, се наблюдава също така загиване на мастни клетки. Ако имате мастна тъкан, която лесно се разширява и образува нови мастни клетки, сте защитени от инсулинова резистентност. Много хора с наднормено тегло, включително сред силно затлъстелите, не стават инсулиноворезистентни и също така са създадени животински модели, които лесно наддават на тегло и не стават инсулиноворезистентни. Както посочих в предишната статия, само хора и животни с липодистрофии, които не могат да складират мазнини по нормалния механизъм, ще развият инсулинова резистентност. Това показва, че мастната тъкан може да стане дисфункционална, когато достигне индивидуална граница на разширяване – граница, която се влияе както от наследствени фактори, така и от околната среда.
Друг аспект при възпалителните процеси е, че висок прием на въглехидрати довежда до високи нива на реактивни оксигени (ROS). Ограничаването на консумацията на въглехидрати (или кетогенните диети) намаляват нивото им както при хората, така и при животните. Една от причините за високи нива на ROS са клетъчни увреждания вследствие на повишена кръвна захар. Високи нива на ROS могат да се получат и от висок натиск върху митохондриите да изгарят свободни мастни киселини.
Способността на митохондриите да изгарят мазнини заема централно място и при инсулиновата резистентност. Нивото на свободните мастни киселини се повишава, защото в кръвта се отделят повече, отколкото се изгарят. Ако повишим изгарянето на мазнини, подобряваме състоянието на заболяването, поради което лечението на метаболитния синдром чрез промяна в начина на живот е свързано с увеличаване изгарянето на мазнини.
Много специалисти по храненето смятат погрешно, че инсулиновата резистентност се причинява от висок прием на мазнини. Според тях приемът на мазнини е причината за затлъстяването, сърдечносъдовите заболявания и всички последващи заболявания. Една от причините да се обвиняват мазнините е, че в проучвания е наблюдавано, че висок прием на мазнини води до инсулинова резистентност. За съжаление тези проучвания често се тълкуват погрешно.
Пример за такова проучване имаме от 2001 г. [5]. Учените дали три различни хранителни режима на здрави мъже в различни моменти и измерили инсулиновата чувствителност след всеки режим. Енергийната стойност и съдържанието на белтъчини на трите режима били еднакви. Мазнините и въглехидратите били разпределени съответно по следните начини: 0% мазнини и 85% въглехидрати, 41% мазнини и 44% въглехидрати или 83% мазнини и 2% въглехидрати. Учените установили, че след висок прием на мазнини черният дроб реагирал по-слабо на инсулина, т.е. произвеждал по-малко въглехидрати, отколкото при другите хранителни режими. Действително е вярно, че един от проблемите при хората, които развиват висока кръвна захар, е, че черният дроб не намалява производството на кръвна захар, както би трябвало, когато бъде изложен на действието на инсулина. Но този проблем се среща при хора, консумиращи много въглехидрати и които в същото време имат висока захар в кръвта от храната.
Високото ниво на кръвната захар е опасно, но ниското ниво може да бъде далеч по-опасно, особено за мозъка. Затова е важно, когато не се консумират въглехидрати (2%), черният дроб да продължи да произвежда глюкоза, за да не спадне кръвната захар прекалено ниско. Именно това се случва, когато се консумират много мазнини. Но това е положителна и естествена адаптация. Ако се продължи с висок прием на мазнини, се получава ниска и естествена кръвна захар, като в същото време се намалява телесното тегло и мазнините в черния дроб, панкреаса и други органи се използват за енергия, което води до подобряване на инсулиновата чувствителност на тези органи.
Учените зад гореспоменатото изследване изглежда са били изненадани от значението на това откритие с оглед на диабета и са написали:
„Учудващо, в
контекста на риска за диабет, 2 аспекта на глюкозната хомеостаза всъщност се
подобриха след прием на HFLC [високомазнинния нисковъглехидратен режим]: понижено базално ендогенно производство на глюкоза
и подобрено инсулин-стимулирано неоксидативно усвояване на глюкозата.”
Въпреки че може
да изглежда, че отключващата причина за инсулиновата резистентност (най-вече в
черния дроб) е, че мастната тъкан е инсулиноворезистентна и отдава прекалено
много свободни мастни киселини, е възможно също така тази представа да е
прекалено опростена. Защото имаме два типа мастна тъкан, които имат
различно поведение. Висцералните мазнини са онези мазнини,
които обгръщат органите и тази мастна тъкан, в противоположност на подкожните
мазнини, изпраща мастни киселини направо към черния дроб. Това е причината
коремното затлъстяване да бъде далеч по-значим рисков фактор за заболяване,
отколкото генерализираното затлъстяване, разпределено равномерно по тялото. Ако
се погледне от този ъгъл, може да бъде достатъчно висцералната мастна тъкан да
бъде инсулиноворезистентна. Както възпалителните процеси, така и стресът
повишават количеството висцерални мазнини, а постепенното натрупване на мазнини
около корема е класически симптом на стрес [6].
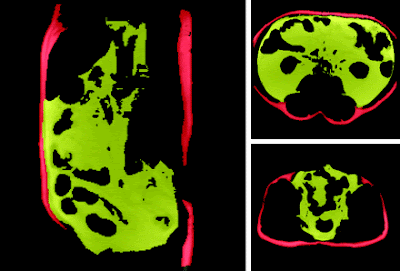
Отделни видове липодистрофии водят до възпрепятстване на складирането на мазнини в подкожната мастна тъкан. Тогава се развива инсулинова резистентност, затлъстял черен дроб и се получава голямо натрупване на мазнини във висцералната мастна тъкан. Изображението показва такъв човек. Жълтото е висцерална мазнина, която се е натрупала около органите, а червеното е подкожна мазнина.
Отделни видове липодистрофии водят до възпрепятстване на складирането на мазнини в подкожната мастна тъкан. Тогава се развива инсулинова резистентност, затлъстял черен дроб и се получава голямо натрупване на мазнини във висцералната мастна тъкан. Изображението показва такъв човек. Жълтото е висцерална мазнина, която се е натрупала около органите, а червеното е подкожна мазнина.
Стресът е важен рисков фактор за метаболитния синдром.
Откриването на причината за инсулиновата резистентност е танц в кръг, при който натрупванията на мазнини, намалената функция на клетките и възпалителните процеси вървят ръка за ръка и е трудно да се установи кое е първото. Но въпреки че все още не разбираме всички механизми, можем да кажем много за това кои лечения работят най-добре. Но още по този въпрос в следващата статия.
Източници:
1. Cohen JC, Horton JD, Hobbs HH: Human fatty liver disease: old questions and new insights. Science 2011, 332: 1519-1523.
2. Donnelly KL, Smith CI, Schwarzenberg SJ, Jessurun J, Boldt MD, Parks EJ: Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. J Clin Invest 2005, 115: 1343-1351.
3. Taubes G: Insulin resistance. Prosperity's plague. Science 2009, 325: 256-260.
4. Ota T, Gayet C, Ginsberg HN: Inhibition of apolipoprotein B100 secretion by lipid-induced hepatic endoplasmic reticulum stress in rodents. J Clin Invest 2008, 118: 316-332.
5. Bisschop PH, de Metz J, Ackermans MT, Endert E, Pijl H, Kuipers F, Meijer AJ, Sauerwein HP, Romijn JA: Dietary fat content alters insulin-mediated glucose metabolism in healthy men. Am J Clin Nutr 2001, 73: 554-559.
6. Adam TC, Epel ES: Stress, eating and the reward system. Physiol Behav 2007, 91: 449-458.
7. Huang-Doran I, Sleigh A, Rochford JJ, O'Rahilly S, Savage DB: Lipodystrophy: metabolic insights from a rare disorder. J Endocrinol 2010, 207: 245-255.
Автор: Pål Jåbekk (Пол Йобек)
Превод от норвежки Анелия Петрунова
Превод от норвежки Анелия Петрунова